遺伝子治療とは
がんの遺伝子治療「CDC6shRNA治療」
遺伝子治療とは
1.遺伝子治療とは
遺伝子治療とは
●遺伝子とは
遺伝子治療についてお話する前に、まず「遺伝子」について説明しましょう。
細胞の核の中には染色体と呼ばれる生体物質があり、22対の常染色体と、男性はXY、女性はXXの性染色体、計46本が存在しています。その染色体の中に、遺伝情報としてのDNAが二重に螺旋状に折りたたまれるように含まれています。
DNAはA、G、C、Tの塩基(それぞれアデニン、グアニン、シトシン、チミン)が多数並んで構成されており、ヒトの全てのDNAには、これらの塩基が対になって約60億個含まれています。
そして、このDNAの塩基配列の中に「遺伝子」と呼ばれる特定の領域が存在し、その数は2万個程度とされています。60億個もの塩基の中で遺伝子の数が2万個と聞いて、遺伝子の数はそれほど多くないと感じる方もおられるでしょう。
この2万個の遺伝子は、生体現象の全てを司る様々なタンパク(酵素、ホルモン、サイトカインなど)の合成に必要なアミノ酸の配列を示す、設計図の役割を持っています。遺伝子に示された情報を、mRNA(メッセンジャーRNA)が読みとって、その情報を基にtRNA(トランスファーRNA)が必要なアミノ酸を集めて、設計目標のタンパクが合成されるのです。
※染色体やその中に含まれるDNA(遺伝子を含む)の全ての遺伝情報を「ゲノム」と言います。因みに、「ゲノム(genome)」は「遺伝子(gene)」と「染色体(chromosome)」の合成語です。
遺伝子とDNAの構造
●遺伝子治療とは
「遺伝子治療」とは、この生命現象の根幹とも言える遺伝子の異常を修正する治療と言えます。(※1)
遺伝的に発生する遺伝病では、正常な生命体として必要な遺伝子の欠落や変性が見られます。後天的に発生する病気(がん、血管系疾患、神経系疾患など)の多くも、遺伝子の突然変異や遺伝情報の狂いによって発生します。
遺伝子治療では、これら疾患の根源となる不足遺伝子の補充や、遺伝情報の乱れに対して関連するRNA(miRNA、shRNA他)などの投与が行われます。
これらの遺伝子やmiRNA、shRNAを、治療のターゲットとなる細胞に送る際には、それらを運搬するものが必要です。この運搬体は「ベクター」と呼ばれます。
ベクターは、治療に用いられる遺伝子などを持って、標的となる細胞の核の中に入り込んで、その遺伝子などを核の中でリリースしなければいけません。そのような力をもつものとして、病原性を消去したウイルスがしばしば用いられます(※2)。
遺伝子治療は、基本的には体内遺伝子治療と体外遺伝子治療の二つに大別されますが、RNA干渉を利用するものやゲノム編集を応用するものなどもあり、遺伝子治療は更に進化を続けていくと考えられます。

※1…遺伝子治療の詳しい定義(広義も含め)
遺伝子治療とは、『疾病の治療や予防を目的として遺伝子または遺伝子を導入した細胞を人の体内に投与すること』と定義されています(出典:厚生労働省「遺伝子治療等臨床研究に関する指針」)。また、miRNA(マイクロRNA)やshRNA(ショートヘアピンRNA) などの遺伝子関連物質を投与して遺伝子の発現を干渉する治療法も、広義としての遺伝子治療に含まれます。
※2…ウイルスは、遺伝子やRNAを運ぶスペースを持つと同時に、細胞の核の中に侵入する力を持つため、遺伝子治療を実施する上で必要不可欠なベクターとして重宝されます。ベクターとして利用される現在の代表的なウイルスは、レンチウイルスとAAV(アデノ随伴ウイルス)です。他には、アデノウイルス、レトロウイルス、最近では国産のセンダイウイルスなどがあります。ウイルス以外のベクターとしてプラスミドなどが挙げられますが、これは標的細胞への導入効率や遺伝子発現期間の点でウイルスに劣ります。
遺伝子治療の種類
遺伝子治療は基本的には以下の二つに大別されます。
- 体内遺伝子治療(in vivo)
遺伝子などを搭載したベクターを直接体内に投与する治療法です。
ウイルスベクターやプラスミドベクターを用いて、薬理効果を持つ遺伝子などを腫瘍に直接注射、もしくは静脈や動脈を介して病変部に送る治療です。 - 体外遺伝子治療(ex vivo)
遺伝子を直接体内に投与するのではなく、体外からいったん取り出した細胞に遺伝子を導入して培養増幅させ、それを体内に再び戻して治療するものです。
これには細胞を培養する必要があるため、再生医療の技術も必要です。以下のようなプロセスになります。
造血幹細胞薬T細胞などの標的細胞を体外に取り出し培養・増幅させる。
↓
その中にベクターを用いて遺伝子を導入する。
↓
遺伝子導入細胞を培養、増幅させる。
↓
点滴で体内に送達する。
遺伝子治療の対象疾患
遺伝子治療は、以下の例にあるように、種々の疾患に対して治療適応となる可能性があります。また、数多くの疾患に対して遺伝子治療の臨床研究が進められています。
<遺伝子治療の例>
| 疾患 | 治療形態 |
|---|---|
| ADA欠損症など単一の遺伝子欠損症 | 先天的に不足している遺伝子を補充 |
| がん | がんを殺すタンパク質を生産する遺伝子の投与 |
| がん、AIDS、神経性疾患など | 疾患の原因遺伝子の働きを抑える人工遺伝子の投与 |
| 閉塞性動脈硬化症、 狭心症、心筋梗塞 | 血管の新生を促す遺伝子を投与 |
2.がん遺伝子治療とは
がん遺伝子治療とは
●がんの特性
「がん」は、様々な観点から定義づけることができ、がんとはこういうものだ、と一言で表すのは実は簡単ではありません。ただし、従来から、がんに特異的な以下の6つの特徴が注目されてきました。
<がんに特異的な6つの特徴>
- 自律的増殖能力
正常細胞は、その増殖の仕方や程度は周囲環境の影響を受けてコントロールされていますが、がん細胞は、他からコントロールを受けずに自発的に増殖をしていく能力を持っています。 - 無限増殖
がん細胞は、増殖を開始したのち無限に持続し続けることができます。 - 血管新生
がん細胞が無限に増殖するためには、細胞分裂・増殖のエネルギーとなる酸素や糖が必要になります。酸素や糖を細胞に運ぶのは血管です。がん細胞は自分に酸素や糖を運ぶ新たな血管を作る(血管新生)力を持っています。 - 細胞死回避
遺伝子が正常に機能しなくなった細胞は、通常では細胞死という自殺モードに入り自己消去します。がん細胞はこの自殺(細胞死)を回避する力を身に付けています。 - 増殖停止命令回避
正常細胞は誤って増殖してしまった場合、周囲から発せられる増殖停止命令に従って増殖を止めます。がん細胞は周りからの制止(増殖停止命令)に従うことなく無尽蔵に増殖をし続けることができます。 - 組織浸潤性、転移能
がん細胞は、自分が分裂増殖をし続けるために、取り囲んでいる正常組織を壊しながら周囲に不規則に広がっていきます(浸潤)。また、血液やリンパの流れに乗って、原病が発生した組織から離れた組織に生着して増殖をし続けることができます(転移)。
がんを治療(消去)することは、上記の6つの特性を阻害するということでもあり、それを実現するために様々な治療薬や治療法が開拓されてきました。特に3.に対応する分子標的薬は既に存在しています。しかし、がんのコントロールは残念ながらまだ完全ではありません。がん遺伝子治療は、1.2.4.5.のがんの主たる複数の特性を制御することを目指します。
<がん遺伝子、がん抑制遺伝子の破綻>
がんの発生には、「がん遺伝子の異常増殖」と「がん抑制遺伝子の突然変異」が背景にあることも知られています。
がん遺伝子は「がん化を進める」アクセルのはたらき、がん抑制遺伝子は「がん化を抑える」ブレーキの働きがあります。遺伝子異常によりアクセルの増強とブレーキの減弱が発生し、細胞が暴走してがん化へと進むことがわかっています。

●がん遺伝子治療のポイント
がんは、遺伝子に損傷を受けた異常細胞の無秩序な増殖によって特徴づけられる病態です。そのような細胞の無秩序な増殖は、細胞分裂の周期が正常に制御されなくなるために生じます。それにより、上記のがんの特性の1.2.4.5.が生じるとも言えます。
では、がんの細胞分裂周期が異常を来すのはなぜでしょう。
その理由として、
- がんの細胞分裂を制御する「がん抑制遺伝子」の変異や破綻
- 「がん遺伝子(がんの無限増殖を促すライセンシングファクターを含む)」の異常増殖
の二つが挙げられます。
よって、がん遺伝子治療は上記1.2.を制御することを目指します。
また、がん治療の切り札として今後期待される遺伝子治療ですが、安全かつ効果的に治療を行うためには以下のポイントも大切になります。
A.がん細胞のみが持つ物質をターゲットとしていること
B.その物質はがん細胞分裂維持に必須のものであること
C.治療での分子生物学的反応は、がん細胞にのみ発生し、正常細胞には何ら影響がないこと
D.遺伝子治療製剤を運ぶベクターが確実にがん細胞に到達して長時間治療効果を維持できること
E.がん細胞に対応する生理活性物質が、がん細胞数に対して数的に圧倒的に多数であること
がん遺伝子治療の特徴
遺伝子治療には、前述のとおり体内遺伝子治療と体外遺伝子治療があります。ここでは一般の固形がん(胃がん、大腸がん、乳がん、肺がんなど腫瘍を形成する一般的ながん)に対して実施されている、体内遺伝子治療の特徴を説明します。(※体外遺伝子治療はCAR-T療法として2017年以降、血液のがんに対して承認され出していますが、免疫療法の中に含むことができる治療となります)。
がん遺伝子治療は、遺伝的に継承された遺伝子(生来持っている生理的な遺伝子)にはたらきかけるのではなく、がん細胞に発生した遺伝子の突然変異や欠落に対して作用する設計になっており、以下の特徴があります。
●正常細胞にダメージを与えない
がん遺伝子治療は正常細胞に作用しない設計になっており、正常細胞を障害することは基本的には考えられません。仮に正常細胞に何らかの影響があるとしても極めて軽度で速やかに改善される程度であるとされています。
●有害事象(副作用)が軽度
抗がん剤、分子標的薬、免疫チェックポイント阻害剤などあらゆるがん治療は有害事象を多かれ少なかれ伴います。これらに時に見られるような、重篤な副作用(骨髄抑制、消化器障害、皮膚・粘膜障害、神経障害、間質性肺炎、重症筋無力症など)が、遺伝子治療にはありません。一過性の発熱血圧変動、倦怠感が見られることはありますが、発生しても治療後まもなく(数十分~1-2時間で)消失します。
●がんの種類に限らず治療効果が期待できる
遺伝子治療でターゲットになる物質や補充する遺伝子は、がんの種類に限らずほとんどのがんで破綻しています。現在提供されている遺伝子治療は、特定のがんに限らず、殆ど全てのがんで治療効果が期待できます。
●前がん病変にも有効な可能性がある
がん細胞は、がん幹細胞という前がん病変から発生することがわかっています。がん幹細胞においても、がん細胞に見られる異常タンパクの発生や遺伝子異常が見られるため、遺伝子治療によりがん幹細胞の障害が修復されがん化を抑えられると考えられます。
●標準治療に干渉しない
がん遺伝子治療は、手術、化学療法、放射線治療、免疫療法など他の治療に干渉することはありません。そのため、標準治療を含めた他の治療と併用できます。ただし、他の治療の副作用が激しく発生して免疫力の低下など生理機能が著しく低下している場合は治療効果が減弱することが考えられます。そのような場合は、副作用の消失と体力の回復をまって遺伝子治療を実施するのが理想です。
がん遺伝子治療の種類
がんの遺伝子治療には、体内遺伝子治療と体外遺伝子治療があります。
-
- 体内遺伝子治療
<特徴>
がんの原因と考えられる遺伝子の発現、がん抑制遺伝子の欠損や突然変異、がんに特異的な異常タンパクを規定する遺伝子情報の破綻、などをターゲットにして、対応する遺伝子やRNAなどを直接体内に投与する治療法です。
<現況>
●投与する遺伝子の種類
悪性胸膜中皮腫や前立腺がんに対するがん抑制因子REIC遺伝子、固形がんに対するTCR、glTCR遺伝子の投与など多くの臨床研究が国内でも実施されており、非小細胞がんに対するP53遺伝子、前立腺がんに対するヘルぺスウイルスチミジンキナーゼなど臨床研究が終了しているものもあります。
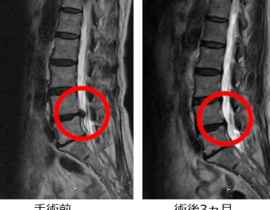
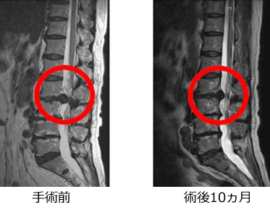
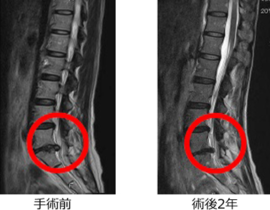
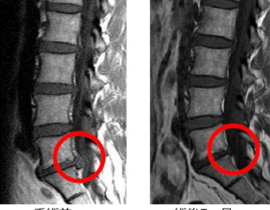
臨床現場では未承認扱いですが、がん抑制遺伝子のP16、PTENなどを投与するものや、CDC6 RNAi 、RA538、GATA3、Ezh2shRNAなどさまざまな導入遺伝子やRNAが治療に応用されています。
●遺伝子を運ぶベクターの種類
体内遺伝子治療の場合は、ターゲットとなるがん細胞の核の中に導入遺伝子やRNAをしっかりと送り届けて効果を発現させるために、運び屋であるベクターが非常に重要になります。現在信頼できるベクターとして、レンチウイルスベクター、アデノ随伴ウイルス(AAV)ベクターなどが期待されます。ベクターの開発は今後さらに進んでいくと考えられます。
<適応>
胃がん、大腸がん、肺がん、乳がん、膵臓がん、腎臓がん、前立腺がん、子宮頸がんなど、全ての固形がんが治療対象になります。
<安全性>
臨床現場で実施されている遺伝子治療においては、一時的な発熱、倦怠感、低血圧などは見られるようですが、重篤な副作用や有害事象が発生していません。
<治療費>
未承認治療として自費診療での実施となっており、各医療機関で異なります。一般的に1回の治療に数十万円は必要です。
- 体内遺伝子治療
- 体外遺伝子治療
<特徴>
キメラ抗原受容体発現T細胞(CAR-T)療法 が代表的です。
これは患者さんから採取した免疫細胞(T細胞)にキメラ抗原受容体(CAR)を発現させる遺伝子改変技術を施し、それを大量に培養してから体内に戻す療法です。T細胞を利用する点では免疫療法、細胞を培養する点では再生医療、これら二つの医療技術も用いられています。
<現況>
米国食品医薬品局(FDA)では2017年9月にCD19標的CAR-T療法である「キムリア」を、同年9月に同じく「Yescarta」を承認しました。固形がんに対しても臨床研究や治験が進んでいます。
<適応>
適応症は急性リンパ芽球性白血病(ALL)やB細胞リンパ腫などの血液がんです。胃がん、大腸がん、肺がんなどの固形がんには適応がありません。今後は固形がんに対しても適応が拡大される見通しです。
<安全性>
一般的な化学療法でみられる正常細胞を障害するような有害事象(骨髄抑制、粘膜・皮膚障害など)は発生しないと考えられますが、サイトカイン放出症候群と呼ばれるインフルエンザ様の症状、毛細血管漏出、神経毒性などのリスクがあり、注意を要します。
<治療費>
治療費負担が大きく、5千万円以上の費用を要するようです。
がん遺伝子治療の副作用やリスク
遺伝子治療の副作用やリスクについて、これまでの経緯を含めて説明します。
●期待に反して事故が続いた黎明期
遺伝子治療の黎明期には、大量に投与されたアデノウイルスベクターに対する過剰な免疫反応が発生し一人の治験患者が死亡しました(1999年 米国 Gelsinger事件)。また、2002年にはレトロウイルスベクターの挿入変異に伴う白血病の発症が確認されました。いずれも、遺伝子治療の成功例が続いていた中での事故であり、関係者には大きなショックでした。
●事故の原因究明
前述した1999年のGelsinger事件は、遺伝子治療の問題ではなく、プロトコールや臨床研究の実施体制に大きな欠陥がありそれが事故の原因と考えられましたが、2002年の白血病の発症は、遺伝子治療の本質的な問題と捉えられました。次世代シークエンサー(DNA分子の配列を短時間で読み取る特殊な装置)により詳細な解析を行ったところ、遺伝子治療でベクターに使用したレトロウイルスが遺伝子を挿入する部位に問題があることが判明しました。細胞の増殖や分化に関連する部位に組み込まれることで、がん化を引き起こすことがわかったのです。
●安全なウイルスベクターの開発
レトロウイルスベクターのリスクが突き止められ、がん化の可能性を減少させた改良型のレトロウイルスベクターの開発が進みました。その後、より安全なレンチウイルスベクターやAAVベクターなど臨床で問題なく使用できると考えられるベクターが登場し、遺伝子治療の研究、開発は大きく飛躍しました。
●現在の体内遺伝子治療は極めて安全
現在、体内遺伝子治療は未承認治療ではありますが、臨床現場で提供されている体内へ直接投与するタイプのがん遺伝子治療には、明らかな有害事象の報告がありません。北青山D.CLINICでも、2009年からレンチウイルスベクターなどの安全なベクターを用いて体内遺伝子治療を1500例程実施しておりますが、重篤な有害事象は経験していません。一過性の発熱や血圧低下などの副作用は見られますが、治療後まもなく回復し、日常生活の質を著しく低下させるようなことはありません。今後、さらに安全かつ治療効果を高めたベクターの開発が進むことが見込まれています。