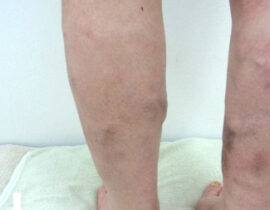
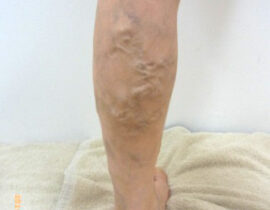
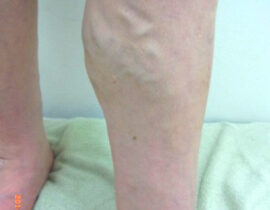
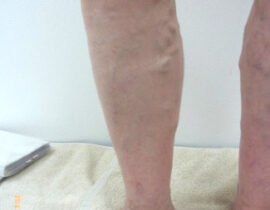
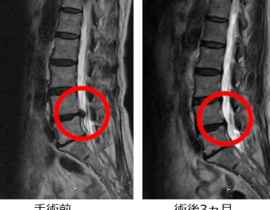
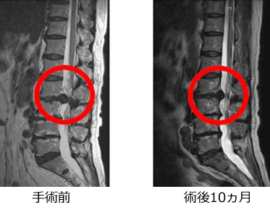
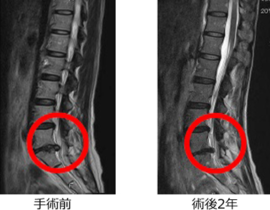
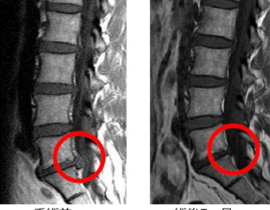
【コラム】CDC6RNAi治療との出会い
がんの遺伝子治療「CDC6shRNA治療」
【コラム】CDC6RNAi治療との出会い
外科手術は、がんの根治的治療として有効ですが、がんが局所にとどまっていることが前提となります。つまり、転移がんや再発がんは、手術では根治できないのです。そして、それらを根治させる治療は、残念ながらいまだ存在しません。
そこで私は考えました。
「ガンの根絶を目指すには、外科医としてのスキルアップも重要だが、それよりも、がんの予防や早期発見(手術により根治できる段階での発見)注力すべきではないか」と。 しかし、がんの完全予防や徹底的な早期発見は現実的には不可能で、むしろ転移がんや再発がんは増加傾向にあります。 がんに対する絶対的な治療は存在しないという現実を痛感しつつ、それでも私は模索を続けました。
そんな中で出会ったのが、遺伝子治療「CDC6 RNAi 治療」です。
まず、「がんを敵と見なさずに、がん細胞を元の正常細胞に戻して、がんと共存していくことを目指す」という考え方に、今までのがん治療にはない斬新さを感じました。 そして、治療の基礎となる複数の背景論文の内容や治療薬設計の論理にも共感を覚えました。
さらに、試薬の作成者であるLuo Feng博士と連絡をとりあい、治療薬の特徴や使用上の注意点、臨床応用の上でのポイントを確認する中で、 「この治療法には、がん治療のあたらたな活路をひらく可能性がある」 との思いに至りました。 そして、
- すでに数十人の日本人が安全にこの治療を受けている
- 良好な経過をたどることが多い
- 複数の患者様が日本でこの治療を継続したいと切望している
といった実状も加味して熟慮を重ね、この治療に着手することにしました。
薬剤発案者へのQ&A
CDC6 RNAi 治療の採用を検討するために、北青山D.CLINIC院長がCDC6 RNAi 治療薬の発案者であるLuo Feng博士に投げかけた質問と、それに対する回答をご紹介します。 Luo Feng博士との直接のやり取りは、院長がCDC6 RNAi 治療の提供を検討する上で、大きな判断材料の一つとなりました。
<質問1>
本治療を要約すると「組み換えRNAにCDC6 RNAi とhTERT(ヒトテロメラーゼ逆転写酵素)を搭載して、がん細胞に送達し、mRNAi(RNA干渉)によりがん細胞中のCDC6を消去して、がんの無限増殖を止め、がん細胞の老化ないしはアポトーシス(自殺)を誘導する療法」ということになると思いますが、端的かつ適切に表現できないでしょうか? 「遺伝子治療」「ウイルス療法」「RNA療法」「mRNAiガン療法」・・・など適切な表現はないでしょうか?
<回答1>
私は一種の遺伝子治療と考えています。とりわけ「無侵襲のがん根絶療法」と言えます。
<質問2>
CDC6タンパクを消去しても、治療効果が得られないがんはありませんか?
<回答2>
私は医師ではないので、どのがんがCDC6 RNAi 療法に反応しないかテストすることができません。
ただ、がんにはかなりの種類があり、同じがんの中にも複数のタイプがありますので、中にはCDC6 RNAi 療法が効きにくいものがあるかもしれません。 私が行った細胞レベルでの検査では、ヒトの神経芽細胞種の複数のタイプの中で、KANRというタイプのものはCDC6 RNAi 療法に反応しませんでした。
このKANRの他に、別のタイプの13種類の神経芽細胞種を対象としてその中にCDC6タンパクが発現しているかどうか調べたところ、KANRと別の2種類のタイプにはCDC6タンパクが確認されませんでした。すなわち、これらはCDC6 RNAi 療法のターゲットがないので、本療法では腫瘍の発育を抑制することはできないことになります。
ただし、これらCDC6タンパクが発現していないタイプのものは細胞培地でほとんど発育しませんでした。
※そもそもCDC6タンパクが発現していなければ、それががんであってもほとんど発育しない。
<質問3>
女性器などにはCDC6タンパクの発現が見られるようだが、仮に健常人に本治療が行われた場合、その安全性は担保されるのでしょうか?
<回答3>
これは非常に良い質問です。私たちの治療試薬は、正常細胞であれがん細胞であれ、すべての細胞の中に侵入していきますが、CDC6 RNAi は非常に特殊な振る舞いをします。
CDC6 RNAi がその作用を開始するためには、hTERT(ヒトテロメラーゼ逆転写酵素)プロモーターにより作動スイッチが入れられなければいけません。 この転写コントロールをおこなう特殊な遺伝子要素は、hTERTゲノム中のエクソン1の部位にあるEBOXです。
正常細胞において、いつ転写を開始、いつ終えるかの指示を出すのがこのEBOXです。 この調整機能はほとんどすべての正常細胞で維持されており、hTERTプロモーターの活動は停止しています。
しかし、ほとんどの人のがん細胞ではゲノムが不安定な状態になっているため、この制御機能が失われてhTERTプロモーターの活動が開始して転写が開始されてしまいます。この特殊な作用を持つEBOXにより正常細胞ではCDC6 RNAi の発現が抑えられて転写がおきないように制御されています。
がん細胞においてのみ、このEBOXの制御が失われてhTERTの活動性が高まりCDC6 RNAi の転写が活発に行われるのです。
<質問4>
点滴やカテーテル治療により、本薬剤はがん細胞に有効に送達されますか?血液中で失活しませんか? また、がん性腹膜炎や胸膜炎において、腹腔内や胸腔内へ本製剤を直接注入しても、腫瘍表面から薬剤が細胞内へ送達されますか? 他に、本製剤をがん細胞へ直接注入する以外に有効な送達法はありますか?
<回答4>
治療薬の構成物は、ヒトの細胞から培養された組織が派生したものなので、血管へ注射により体内に送り込むことはできますが、短時間で失活してしまいます(血中では2時間未満で失活します)。
このため腫瘍(がん)に直接注射するのが最善の方法です。
しかし、実際にはそれが難しい場合もあります。 その欠点を回避するために、私たちの研究所では両親媒性の微粒子を開発しました。 これはCDC6 RNAi を運んで機能させるプラスミドでcytonacxと命名しました。 この新しいタイプの治療薬は血液中で安定しており、大きな分子複合体で生体内で他の成分と共存でき、かつ生体内で分解されるので、静脈注射で生体内へ送り込むことができます。
<質問5> 本治療薬を腫瘍に直接注入するとして、腫瘍のサイズ・量に応じて、それを完全に除去するために必要な薬剤量を理論的に算出することはできますか? 例えば直径1㎝のがん細胞を完全に除去するのに総量で何mlあれば良いのですか?
<回答5>
現状では算出できません。必要量を決定するためのヒントとなる文献を探してみます。
※当院ではその後の治療経験から、がんの広がりや病期に応じて投与量を決定しています。 末期がんに対する治療が中心になっているため何ml投与すれば完全に治せるというものではありません。
がんの病勢をコントロールした後、定期的に追加投与をすることで癌を眠らせ続ける(自殺させる)ことを目指します。
<質問6>
がん種の中で、本治療がもっとも有効と考えられるのは?
<回答6>
私たちが本薬剤を設計した当初は、がん細胞がCDC6タンパクによって細胞分裂しているのであれば、がん細胞の複製を抑えると考えていました。しかし、例えば成長が遅く分裂が乏しい胃がんなどの場合はCDC6 RNAi 治療薬の効果の評価は難しいのです。それらのがん種では本治療薬のみで治療効果を上げるのは難しいかもしれません。
※当院では胃がん、乳がんの患者さまが来院されることが多く、その分著効例も多くなっています。
以下、原文
question 1
If I understand correctly, this therapy in general terms seems to attach and hTERT to recombinant RNA in order to be delivered to the cancer cell and then knocks down the CDC6 in the cancer cell through mRNAi to arrest the unlimited proliferation of the cancer and cause cellular senescence and/or apotosis. I was wondering if there may be a more succinct way of explaining this. Similarly, have you decided on an appropriate naming for this therapy? Such names as gene or genetic therapy, virus therapy, RNA therapy or mRNA therapy come to mind.
For your question 1:
I think this is a kind of gene therapy, in specific, it is a Non-Invasive Cancer Eradication (NICE) treatment;
question 2
Have you found any cancers for which knocking down the CDC6 is not effective?
For your question 2:
I am not a doctor, so I could not have chance to test which kind of human cancer is resistant to CDC6 shRNA. I believe that there might be many kinds of cancers, or different types of same cancer that are resistant to CDC6 shRNA mediated treatment. In my cell tests, a human neuroblastoma cell line, KANR, displayed no response to CDC6 shRNA. We have examined the expression of Cdc6 in this tumor cells and other 13 different primary neuroblastoma cells. KANR, with other two cell lines could not be positive for Cdc6 expression. Therefore, CDC6 shRNA is hardly find its target in the tumor cells, doing nothing on suppression of tumor cell growth, though this kind of tumor cell grow poorly in the culture.
question 3
The expression of CDC6 is also seen in, for instance, female genitalia. Is the safety of this therapy guaranteed even if used in healthy individuals?
For your question 3:
This is a very good question. I only can say our therapeutic reagents enter cells whether it is normal or cancerous one, but the production of CDC6 shRNA will be much different. The CDC6 shRNA expression is driven and controlled by human telomerase reverse transcriptase (hTERT) promoter. In this specific transcription control gene element, a novel E-box located in the exon 1 of the hTERT genome. It is this downstream E-box that can tell when the transcription should be on and when should be off in normal cells. This regulation mechanism is maintained in most normal somatic cells and keeps the hTERT promoter activity in repression status. However, as results of genome instability in many kinds of human cancers, this control function is lost in these cancer cells, leading to the activation of transcription. We use E-Box this specificity to control CDC6 shRNA expression and to let the transcription in normal cells or in cells like you have cited to be silent. Only in cancer cells in which hTERT activity is higher is the CDC6 shRNA transcription activated due to the E-Box repression effect has been lost.
question 4
Can this therapy be effectively delivered to tumors intravenously orvia catheter, or does the therapy become deactivated in the bloodstream. Likewise, in the case of cancerous peritonitis or pleurisy can the drug be effectively delivered into the tumor cells from the tumor surface if injected into the peritoneal or thoracic cavities, respectively? In other words, is there no other treatment than to directly inject the drug into the tumor?
For your question 4:
Due to final forms of therapeutic components are derivatives of tissue cultured human cells, they can be introduced into body intravenously, but will be inactivated or degraded very soon (less than 2 hours in blood stream). For this reason, direct injection into tumor foci is best way. However, it is hard to accomplish in practice. To circumvent this drawback, our RNTein Biotech Lab. has developed an amphiphilic nanoparticle, we called Cytonacx carrying CDC6 shRNA producing plasmid. This novel kind of therapeutic reagent is stable in bloodstream and its large molecular co-polycomplex is biocompatible and biodegradable, and can be introduced into body intravenously.
question 5
With this drug, assuming direct injection, is it theoretically possible to determine the volume required to completely eliminate a tumor based on its total mass. For instance are you able to determine how many ml are required to eliminate a tumor 1 cm in diameter?
For your question 5:
My answer is no. I will find some reference which may help you to do some estimation.
question 6
Of the various carcinoma, is there one in particular, such as gastric carcinoma or poorly-differentiated carcinomas, for which you consider this therapy to be most effective?
For your question 6:
When we designed AJS2001, it will suppress cancer cell proliferation as long as the cell makes use of Cdc6 in the initiation of DNA replication. However, many tumors, such as human gastric tumor with slow growth and poor differentiation, the effect of CDC6 shRNA mediated treatment is hard to evaluate. I really think that AJS2001 alone would do poor job in treating such kind of tumor. However, combining with Cytonacx, specifically use Cytonacx carrying some tumor suppression protein-producing vector, such as p53, p16, pGAdd45a etc. may produce nice results.